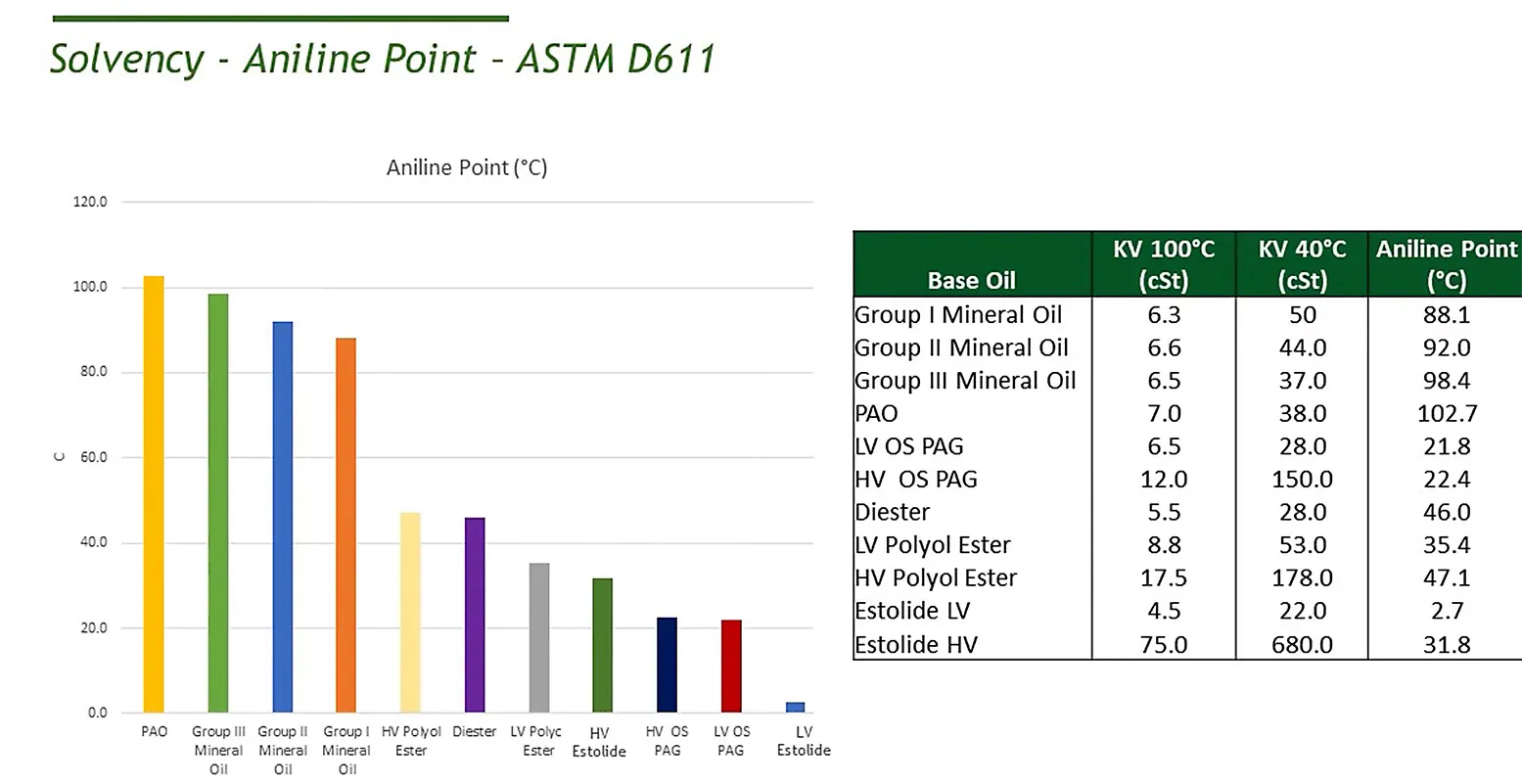
"Der Anilinpunkt ist definiert als die minimale Temperatur, bei der eine Mischung aus Öl und Anilin im Volumenverhältnis 50:50 noch eine echte Lösung bilden kann. Unterhalb dieser Temperatur tritt eine Phasentrennung von Anilin und Öl auf. Mit anderen Worten, der Anilinpunkt gibt die Phasentrennungstemperatur für diese Mischung an. Da das Anilinmolekül sowohl polar als auch leicht polarisierbar ist, besteht eine starke molekulare Bindung zwischen Anilin und anderen aromatischen Verbindungen, deren Moleküle aufgrund des Vorhandenseins delokalisierter π-Elektronen ebenfalls eine hohe Polarisierbarkeit aufweisen.
In der Literatur wird oft behauptet, dass es eine nahezu lineare Beziehung zwischen dem Anilinpunkt und der Kauri-Butanol-Zahl für Kohlenwasserstoffe gibt. Wie in Abbildung 1 gezeigt, wird diese lineare Beziehung jedoch nur annähernd und nur unter der Bedingung aufrechterhalten, dass der Gehalt an aromatischen Verbindungen nicht zu hoch ist. Viele alkylsubstituierte Aromaten mischen sich bei Raumtemperatur mit Anilin und liegen außerhalb des linearen Teils der KB-gegen-AP-Grafik. Polare Lösungsmittel, bei denen spezifische intermolekulare Wechselwirkungen einen signifikanten Einfluss auf das Lösevermögen haben, können eine noch ausgeprägtere Nichtlinearität zeigen.
Der Anilinpunkt wird üblicherweise als Maß für das Lösevermögen von Öl betrachtet: Je niedriger der Anilinpunkt des Öls, desto höher ist sein Lösevermögen. Aus theoretischer Sicht kann der Anilinpunkt als die Temperatur definiert werden, bei der die Löslichkeit von Anilin in Öl (oder von Öl in Anilin) 50 Vol.-% erreicht. Die Verwendung eines vordefinierten Volumenverhältnisses vereinfacht das Messverfahren erheblich, da für jedes Öl nur eine Trübungspunktmessung erforderlich ist. Gleichzeitig erschwert dies die theoretische Beziehung zwischen dem Anilinpunkt und thermodynamischen Funktionen wie freier Energie, Enthalpie und Mischungsentropie, da diese traditionell auf molarer Basis definiert werden. Für eine Mischung aus Anilin und Öl im Volumenverhältnis 50:50 beträgt das molare Verhältnis der Komponenten ρ_anil / M_anil Mol Anilin zu ρ_oil / M_oil Mol Öl (wobei ρ die Dichte und M die molare Masse ist) und kann von 2 für niedrigviskose Öle bis 5 und mehr für hochviskose Öle variieren."